
研究背景:光动力疗法(PDT)由于时空调控精度高和组织侵入性低,已发展成为一种有效的肿瘤治疗策略。PDT借助智能光敏剂(PS)通过I型/II型反应释放活性氧(ROS),触发细胞凋亡或坏死杀伤肿瘤。ROS还可通过激活急性炎症、增强肿瘤免疫原性及改善T细胞浸润诱导强大的免疫原性细胞死亡(ICD)。因此,PDT联合免疫治疗已被广泛应用于浅表和远端肿瘤的临床治疗,但PDT联合免疫治疗仍面临着一些重大挑战,如乏氧实体瘤中氧气严重不足和光穿透深度受限,极大地降低了治疗效果。基于这些事实,因氧气消耗和光照依赖性低,可产生内源性I型ROS的化学免疫疗法将成为提高肿瘤治疗效果的一个更具吸引力的选择。然而,目前所报道的I型ROS诱导的化疗免疫治疗由于肿瘤微环境多变,药代动力学复杂,临床应用前景尚不理想。因此,开发可产生内源性I型ROS爆发实现乏氧肿瘤的化学免疫治疗,同时还可提供浅表肿瘤的光动力免疫治疗的“一体式”治疗平台具有十分重要的科学意义。
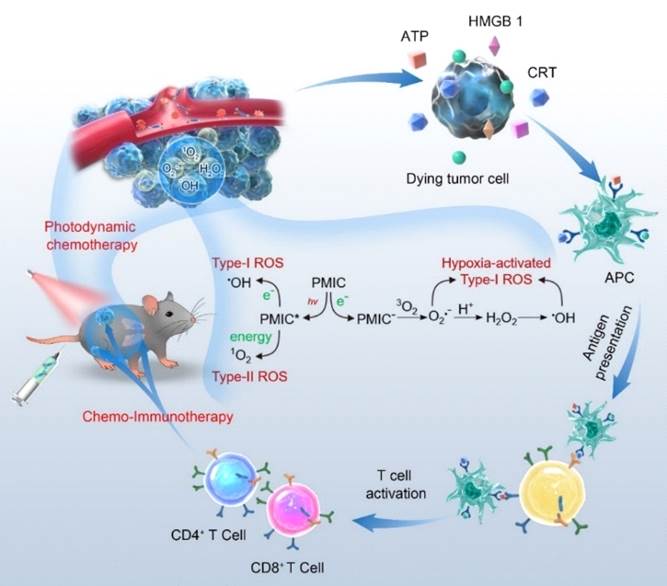
图1. NIR及质子驱动的苝活性氧超级发生器用于乏氧肿瘤三模态治疗。(来源:Angew. Chem. Int. Ed.)
研究内容:
针对上述挑战和问题,天津理工大学王铁教授领衔的科研团队与河南大学基础医学院黄永伟教授合作,通过在苝酰亚胺结构的迫位引入供电子脂肪胺取代基团,制备两种单酰亚胺衍生物。该类苝酰亚胺衍生物具有给体-受体结构,在引发吸收光谱红移的同时,可调节能级带隙,实现了近红外光照下I型和II型ROS高效产生。同时,该类化合物还可以产生内源性I型ROS,实现三种途径的ROS生成。该ROS超级产生器可诱发肿瘤细胞凋亡,激活肿瘤细胞强烈的ICD效应,高效抑制皮下肿瘤、远端肿瘤和肺转移瘤的生长,实现了肿瘤的化学、光动和免疫联合治疗。
如图2所示,研究人员合成了叔铵盐和季铵盐的PMIC-NC和PMIC-MC,并引入给电子的N,N'-二甲基乙二胺,以形成受体-供体分子骨架结构,从而使该类分子具有NIR区的吸收和发射。分子内扭曲的受体-供体骨架结构可触发系统间电子交叉,进而提高光动力治疗效率。将烷基胺基与碘化甲酯或氢碘酸反应,可得到带正电荷的铵基,以提高了PMIC-NC和PMIC-MC的水溶性。经光谱测定,PMIC-NC和PMIC-MC分别在630-730 nm和650-800 nm显示出较强的吸收峰和荧光发射峰,1O2量子产率分别为10.45%和10.09%,二者可在激光照射下很好地生成I/II型ROS,这使它们成为实现肿瘤高效PDT的候选光敏剂。随后的细胞毒性实验结果则表明,经660 nm激光照射后,PMIC-MC可表现出更强的I型/II型ROS的生成能力和更佳的细胞毒性。

图2. PMIC-NC和PMIC-MC的化学结构及相关性能测试。(来源:Angew. Chem. Int. Ed.)
为了揭示PMIC-NC产生优异肿瘤细胞毒性的作用机制,研究人员监测了肿瘤细胞内源性ROS爆发情况,结果表明PMIC-NC可在无激光照射下有效触发内源性ROS的生成。研究人员猜测造成这一实验现象的原因可能是由于乏氧肿瘤细胞内还原物质的大量积累,苝易被还原为离域的自由基阴离子,这些苝自由基阴离子可将电子转移到O2,从而促进O2•-的生成,而O2•-可触发级联反应以加速形成高度细胞毒性的自由基,如H2O2和•OH(图1)。另外,细胞荧光染色结果表明PMIC-NC可精确地靶向线粒体,促进内源性ROS爆发,引起钙超载,诱发严重的内质网应激,进而有效地触发癌细胞的凋亡。作为级联反应,PMIC-NC或PMIC-NC在光照后还可通过体系激活的内质网应激进一步诱导免疫相关的ATP分泌、CRT表达和HMGB1的释放,在体外激活肿瘤细胞强烈的ICD效应。
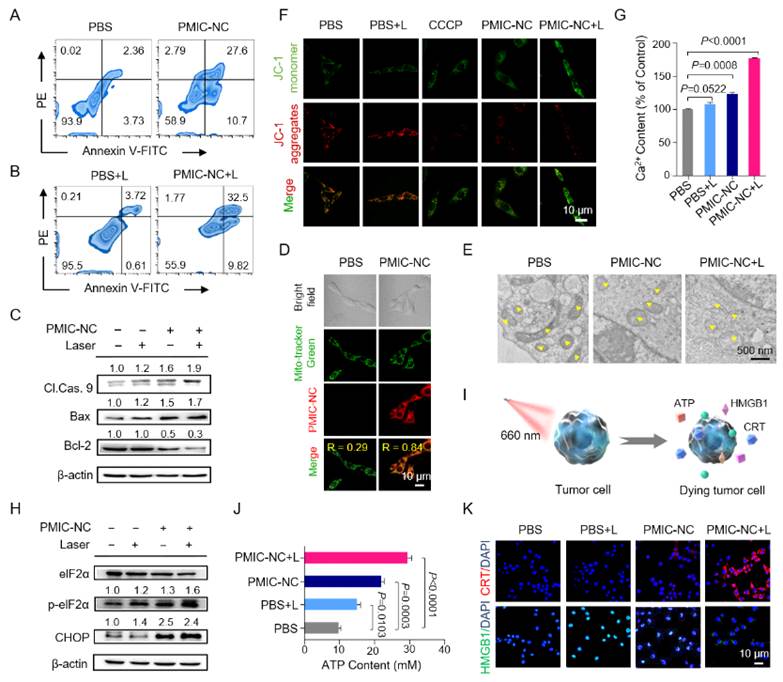
图3. PMIC-NC产生优异肿瘤细胞毒性的相关机制探究。(来源:Angew. Chem. Int. Ed.)
受PMIC-NC对肿瘤细胞优越杀伤活性和ICD诱导作用的启发,研究人员以B16荷瘤的双侧和肺转移C57BL/6小鼠模型系统性地评价了PMIC-NC分子对原发性、远端及转移性肿瘤的治疗效果。图4所示的实验结果表明,PMIC-NC分子介导的光动力化学免疫治疗不仅能抑制原发和远处肿瘤的增殖,并通过触发远端效应,实现良好的抗肿瘤转移效果。此外,PMIC-NC还可有效加速原发性肿瘤和肺转移性肿瘤中DC细胞的募集,通过ICD效应激活辅助T细胞和细胞毒性T细胞,有效抑制局部和远端肿瘤(图5)。体内生物安全性和生物相容性实验则充分证实了PMIC-NC这类小分子化合物有望成为一种非常具有临床应用前景的癌症光动力化学免疫治疗前药。
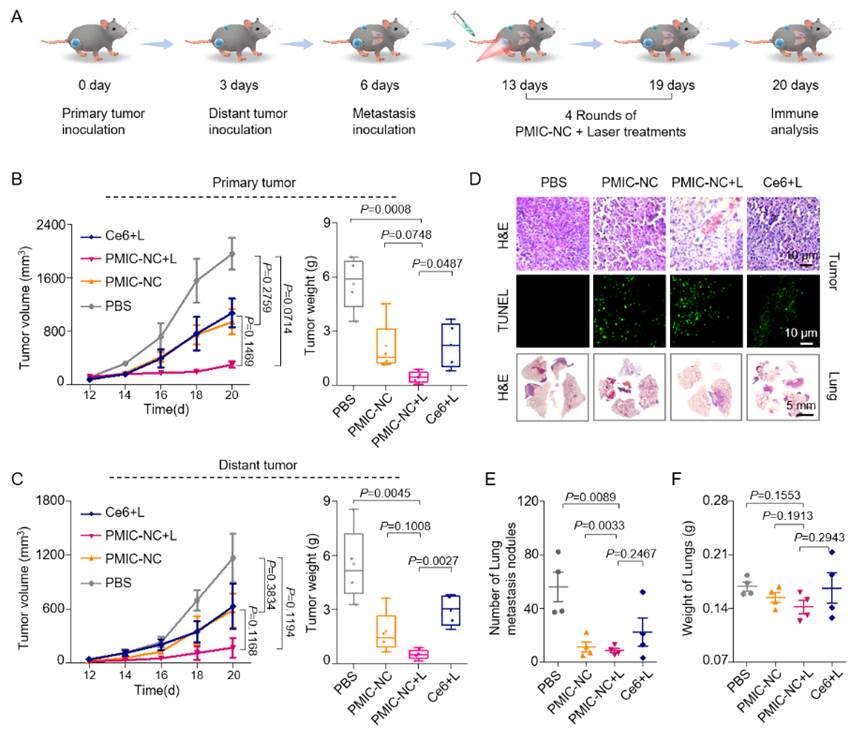
图4. PMIC-NC对原发性、远端及转移性肿瘤治疗效果评估。(来源:Angew. Chem. Int. Ed.)

图5. PMIC-NC在动物体内触发抗肿瘤免疫反应效果评估。(来源:Angew. Chem. Int. Ed.)
该研究工作成功地开发了一种集成近红外光触发的光动力疗法、乏氧激活的化疗以及ICD诱导的免疫治疗的新型多合一肿瘤治疗剂,首次为苝作为有效实现对原发性、远端和转移性肿瘤的三模态集成肿瘤治疗平台提供了概念证明,也为通过分子工程构建ROS超级发生器提供了新的见解和设计指南。
该研究成果以“NIR- and Proton-Driven Perylene Reactive Oxygen Species Super-Generator for Trimodal Therapy Against Hypoxic Tumors”为题发表于Angew. Chem. Int. Ed.。(DOI:10.1002/anie.202214586)
本研究工作在王铁教授及黄永伟教授的专业指导下完成。
这项工作得到了国家自然科学基金、河南省自然科学基金会和河南省大学创新研究团队项目的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/ange.202214586